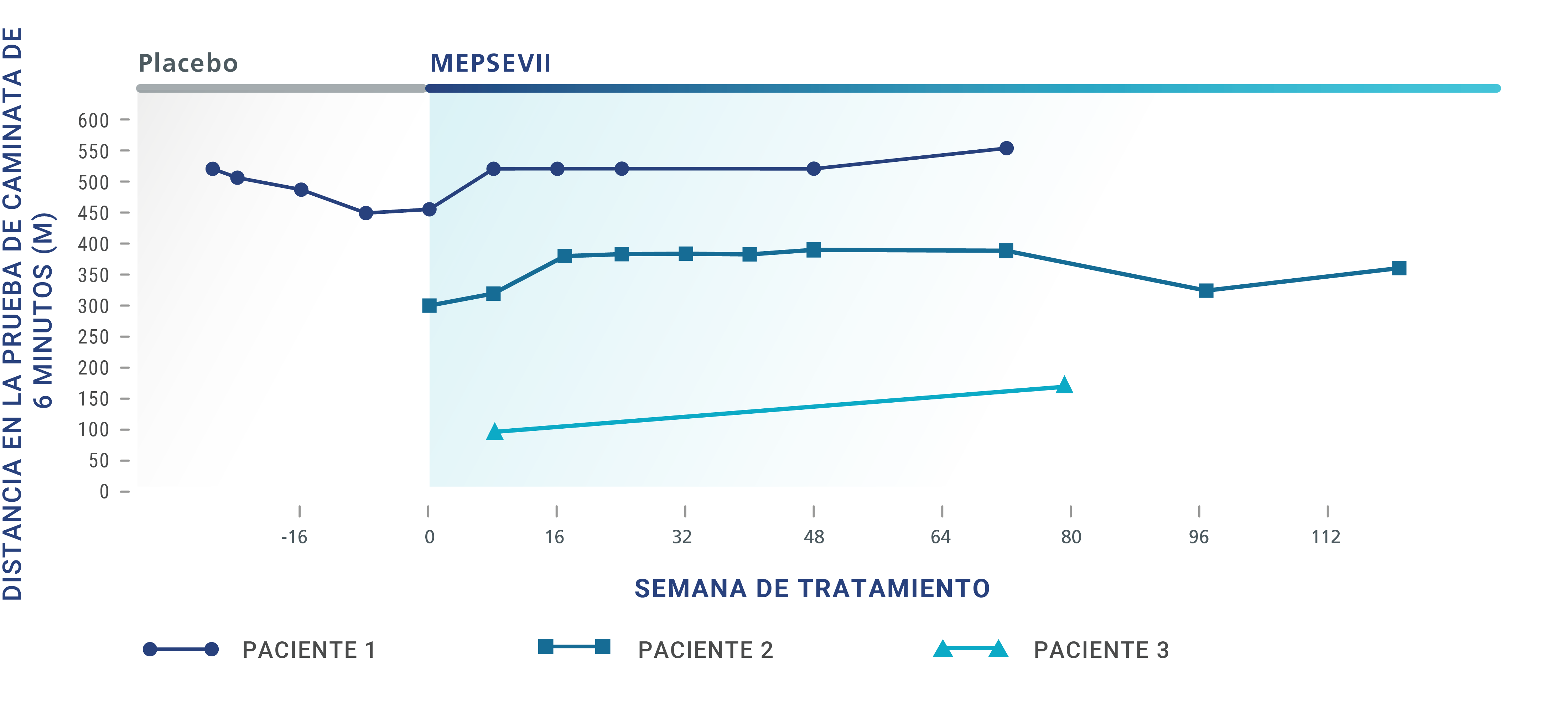
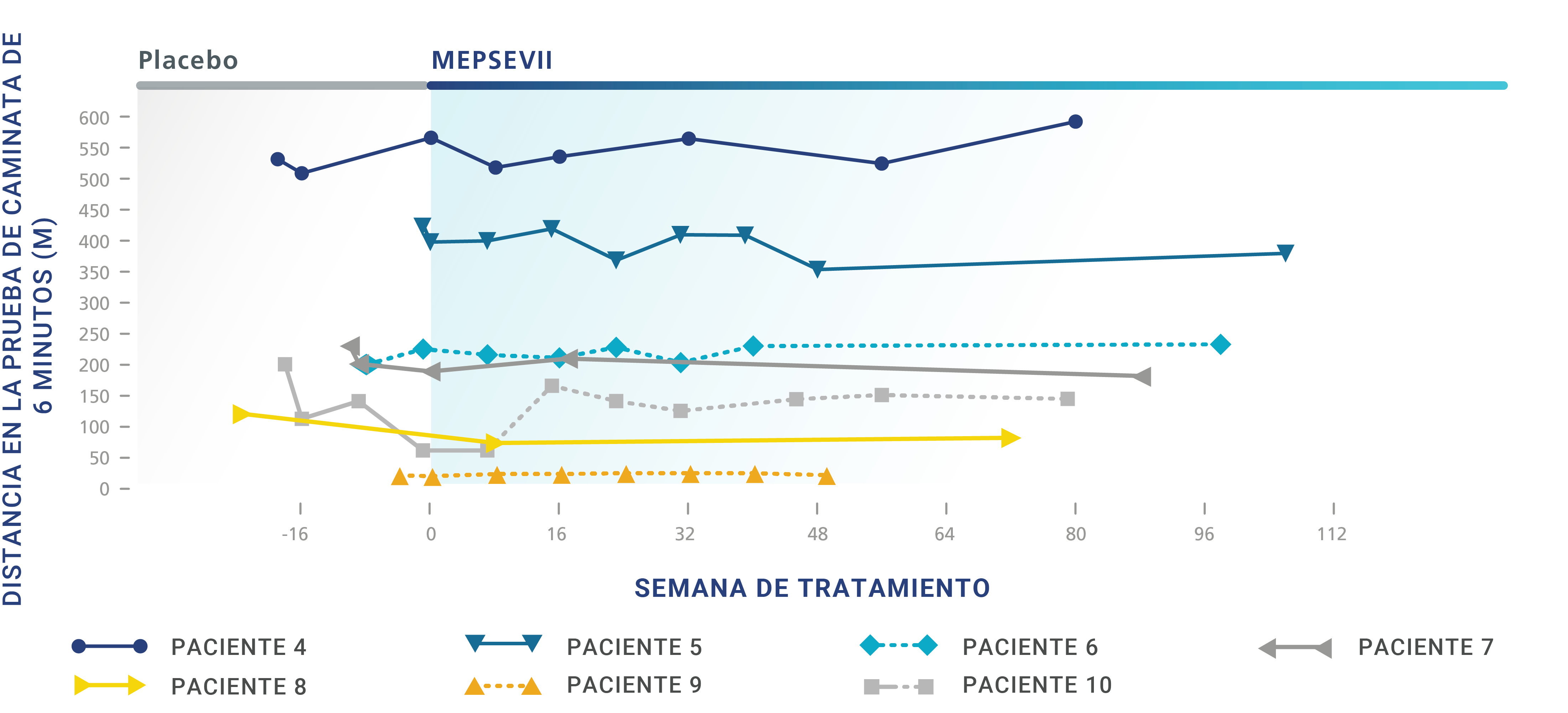
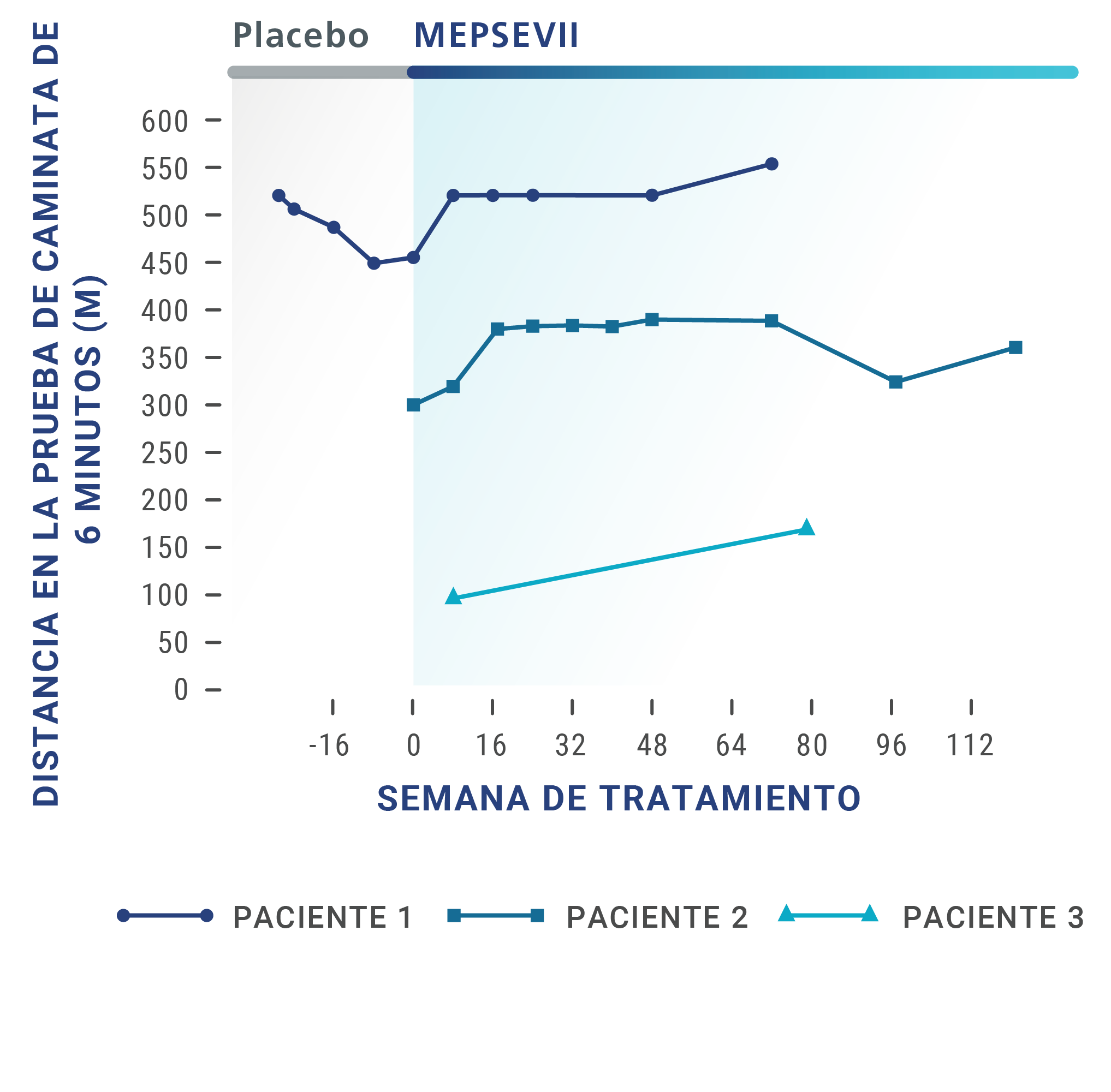
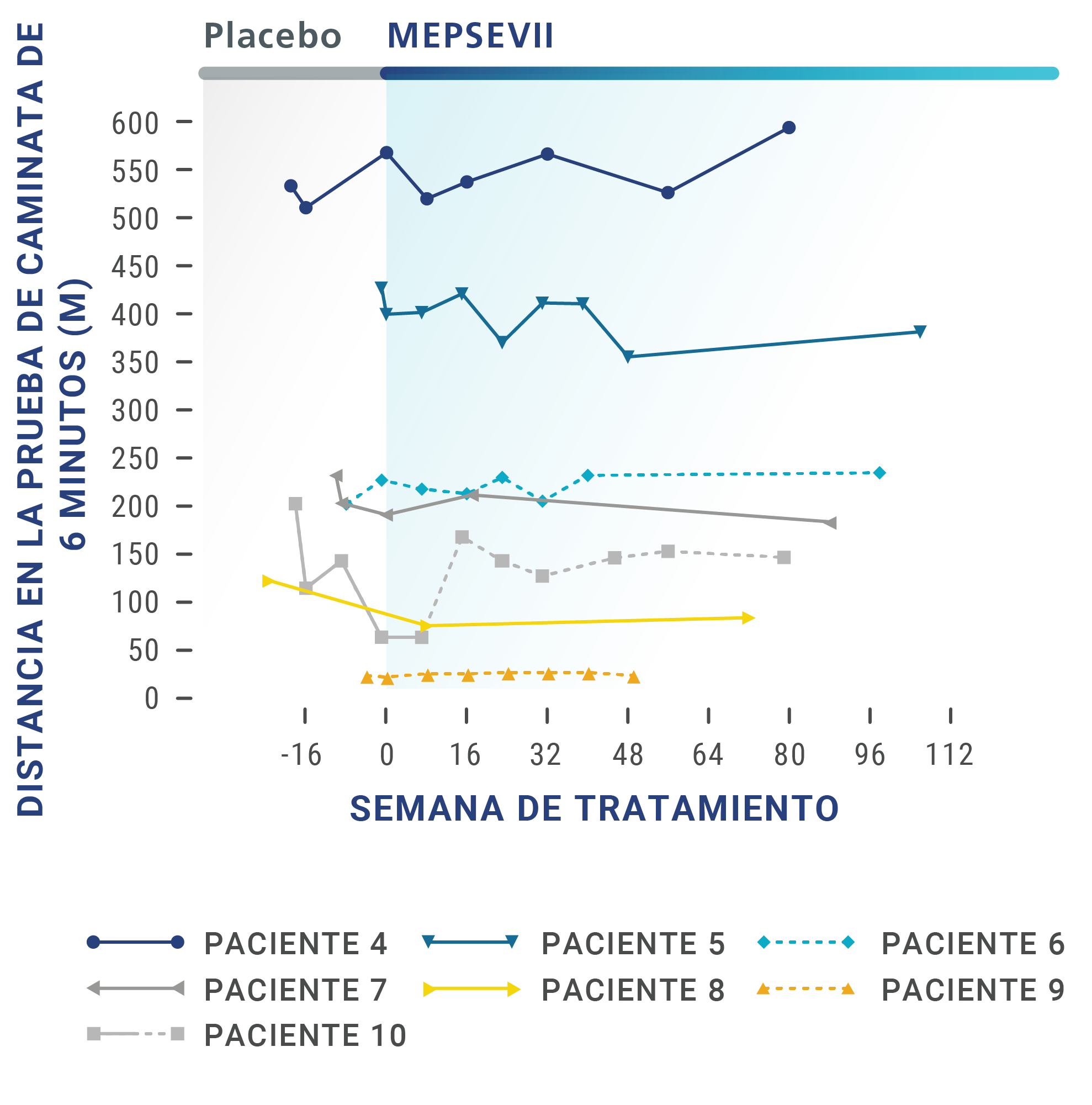
Pacientes con MPS VII confirmada que recibieron MEPSEVII fueron estudiados por hasta 164 semanas. Para determinar la eficacia de MEPSEVII, se utilizaron varias pruebas, como las siguientes:

Prueba de caminata de 6 minutos (6-Minute Walk Test, 6MWT),
en la cual se mide la distancia que la persona puede caminar en 6 minutos. Es una forma eficaz de medir el funcionamiento de los diferentes sistemas del cuerpo en conjunto.
Capacidad respiratoria,
que se mide para conocer la salud del sistema respiratorio.

Tamaño del hígado y el bazo,
para saber si estos órganos tienen un tamaño normal o anómalo.
Debido a la naturaleza de la MPS VII y las diferencias en los pacientes de este ensayo, usted debe hablar con su médico acerca de qué puede esperar del tratamiento con MEPSEVII
En los ensayos clínicos, algunos pacientes que recibieron MEPSEVII presentaron una mejoría o un mantenimiento de la distancia de caminata, la capacidad respiratoria o el tamaño de los órganos.
- Se ha producido una reacción alérgica grave, llamada “anafilaxia”, desde la primera dosis del tratamiento con MEPSEVII.
- Su médico lo controlará atentamente en busca de signos de una reacción alérgica durante el tratamiento con MEPSEVII y durante 60 minutos después de la infusión.
- Su médico interrumpirá inmediatamente la infusión de MEPSEVII si usted presenta anafilaxia.
- Su médico debe informarle los signos y los síntomas de la anafilaxia, así como acerca de que debe buscar tratamiento médico de inmediato si los presenta.
- Los efectos secundarios más frecuentes de MEPSEVII son los siguientes:
- Filtración de MEPSEVII hacia los tejidos cercanos durante la infusión
- Diarrea
- Erupción cutánea
- Reacción alérgica grave (anafilaxia)
- Hinchazón en el lugar de la infusión
- Hinchazón alrededor del lugar de la infusión
- Comezón intensa en la piel
- Durante el tratamiento con MEPSEVII, un paciente presentó una convulsión durante un episodio febril.
- Si está embarazada, piensa que podría estar embarazada o planea quedar embarazada. No hay experiencia suficiente para saber si MEPSEVII podría dañar al feto.
- Está amamantando o planea amamantar. No hay experiencia suficiente para saber si MEPSEVII pasa a la leche materna. Consulte a su médico sobre la mejor forma de alimentar a su bebé durante el tratamiento con MEPSEVII.
Estos no son todos los posibles efectos secundarios de MEPSEVII. Consulte a su médico para obtener asesoramiento médico sobre los efectos secundarios.